基于金纳米笼的诊疗一体化平台用于光声成像指导下的肿瘤
放射/光动力/光热三模态协同治疗
2018-11-27
放射疗法是临床上最为广泛使用的癌症治疗手段之一。但是放射疗法不具有选择性,易复发,因此研发高效的靶向型放疗增敏剂具有非常重要的意义。传统的放疗增敏剂大多为有机小分子,存在功能单一,不具备肿瘤组织靶向性,水溶性差,体内循环时间短等诸多缺点。基于目前的研究现状,我们设计、构建了透明质酸修饰的金纳米笼多功能诊疗一体化平台,实现了肿瘤的光声成像以及放射/光动力/光热三模态协同治疗。
我们利用材料表面的透明质酸可以与肿瘤细胞表面的CD44的靶向性结合的特点,通过透明质酸的修饰使金纳米笼具有主动靶向肿瘤组织的能力。金纳米笼由于其独特的LSPR吸收峰,常用于癌症的光热成像和光热治疗。同时金对高能射线(例如:X-ray)有很好的吸收以及散射等作用,可以使粒子附近局域范围内射线强度大大增强,可以使用更低剂量的高能射线,达到优越的放疗效果,从而有效降低放疗毒副作用。此外光热疗法可以加快局域范围血流速度,增加肿瘤组织微环境的氧含量,因此将二者协同就可以增强肿瘤的治疗效果。同时金纳米笼对肿瘤具有一定的光动力治疗效果,光动力疗法又可以有效杀伤对放射线有很强耐受能力并处于非分裂期的肿瘤细胞。综上所述,我们构建的透明质酸修饰的金纳米笼可以在光声成像技术引导下准确判断出肿瘤组织的位置,并通过X-ray和近红外激光照射实现肿瘤的放射疗法、光动力疗法以及光热疗法的三模态协同治疗。细胞实验与动物实验表明,单一模态的治疗效果有限,不能完全抑制肿瘤组织的生长,而该多模态诊疗一体化纳米平台具有良好的生物相容性以及肿瘤组织靶向性,通过放射/光动力/光热三模态协同疗法取得了远好于单一模式的治疗效果。该工作为高效、精准肿瘤诊疗提供了一种很好的思路。
该工作由课题组硕士生徐小雨等完成,近期被国际学术期刊Acta Biomaterialia接受。
Xiaoyu Xu, Yu Chong, Xiaoyun Liu, Han Fu, Chenggong Yu, Jie Huang*, Zhijun Zhang*. Multifunctional Nanotheranostic Gold Nanocages for Photoacoustic Imaging Guided Radio/Photodynamic/Photothermal Synergistic Therapy. Acta Biomaterialia, published online, Nov, 27, 2018, DOI: 10.1016/j.actbio.2018.11.043.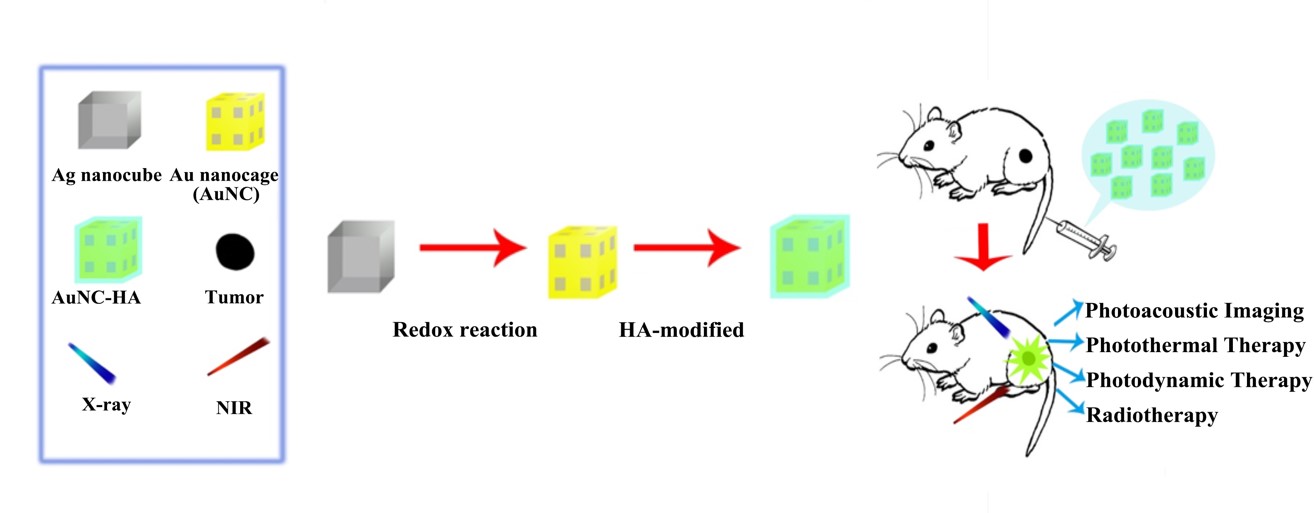
图1. 透明质酸修饰的金纳米笼用于光声成像指导下的肿瘤放射/光动力/光热三模态协同治疗示意图。