基于吲哚菁绿/磁性碳纳米颗粒的磁共振/近红外荧光双模态成像及光热治疗的纳米诊疗一体化平台的构建
2017-04-25
癌症对人类健康与生命安全构成极大威胁。在传统的癌症治疗策略中,诊断与治疗两个过程往往是分立的,不利于对患者进行个性化治疗。纳米技术的兴起有望解决这一问题。通过合理的设计与合成,将具有不同功能的组分集中在同一个纳米平台上,可以构建同时具有诊断和治疗功能的诊疗一体化纳米平台。而且通过增强渗透性和保留(EPR)效应,或者在纳米载体上引入对肿瘤有特异性靶向作用的分子,纳米材料可以通过被动或主动靶向的方式准确到达肿瘤部位,并在肿瘤部位蓄积,可以更好地对肿瘤进行诊断与治疗。
吲哚菁绿(ICG)是美国食品与药物管理局(FDA)批准的可用于临床诊断的近红外成像造影剂,同时它还具有良好的光热转换性能,可用于肿瘤的光热治疗。但是单独的ICG光稳定性差、体内循环时间短、对肿瘤无靶向作用,限制了其在肿瘤个性化治疗中的应用。
本课题组前期工作表明,利用快速化学氧化法制备的碳纳米颗粒(CNPs)具有良好的生物相容性,对小分子药物具有较高的负载性能,同时可以有效改善其光稳定性以及光热性能(J. Mater. Chem. B 2014, 2, 2184-2192;Carbon, 2016, 97, 35-44)。此外,我们前期工作发现,通过原位生长的方式将磁性纳米颗粒与碳纳米材料复合,形成Fe3O4/GO以及Fe3O4/GQD等多功能纳米材料,可以显著提高其磁共振成像性能(Sci. Rep. 2016, 6, 23392-23402;ACS Appl. Mater. Interfaces 2011, 3, 4085-4091)。因此通过该方法在CNPs上原位生长磁性纳米颗粒有望获得良好的磁共振成像效果,弥补近红外荧光成像组织穿透弱、空间分辨率低的缺陷。
基于以上考虑,本课题组博士生宋赛杰等首先利用化学氧化法快速制备CNPs,再在其表面原位共沉淀生长四氧化三铁纳米粒子形成磁性碳纳米颗粒(MCNPs),然后通过物理吸附的方法负载ICG,最后包覆一层牛血清白蛋白(BSA)以提高其生物相容性。实验发现,负载在MCNPs表面后ICG的光稳定性得到显著提高,进而获得比游离ICG更好的光热效果。体内近红外荧光成像以及磁共振成像结果显示,该纳米诊疗剂可以快速地靶向到肿瘤部位,6 h后其在肿瘤部位浓度达到最大值。通过测定不同时间血液中ICG荧光强度可知,该纳米材料在体内的循环时间较游离的ICG显著延长。动物实验结果表明,通过光热治疗,小鼠的肿瘤完全消失,并且其生理指标及主要器官都恢复到正常水平。该纳米诊疗一体化平台的构建为利用纳米技术对肿瘤的早期诊断与治疗提供了一个新的思路。
该工作近期发表在国际学术期刊ACS Applied Materials &Interfaces上。
Song, S. J.; Shen, H.*; Yang, T.; Wang, L. N.; Chen, H. B.; Zhang, Z. J.* Indocyanine Green Loaded Magnetic Carbon Nanoparticles for Near Infrared Fluorescence/Magnetic Resonance Dual-Modal Imaging and Photothermal Therapy of Tumor, ACS Appl. Mater. & Interfaces, 2017, 9, 9484-9495.
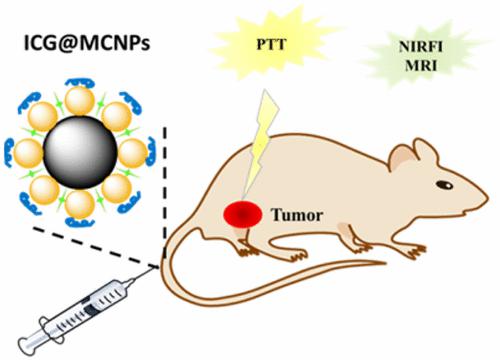
图1 ICG@MCNPs用于对肿瘤的NIRF/MR双模态成像及光热治疗示意图。