基于碳纳米颗粒的智能递药系统及其在肿瘤诊疗一体化领域的应用
2018-09-14
化疗是目前临床上最为常用的治疗肿瘤的方法之一。为克服化疗药物的溶解度低、肿瘤靶向性差、体内循环时间短、容易突释等缺点,研究人员已经开发了大量的纳米载体用于化疗药物的递送。然而,传统的药物递送体系及单一的化疗已经难以满足针对患者特殊病情个性化治疗的需求。因此,构建智能载药系统及诊疗一体化纳米平台,借助外源/内源刺激响应调控药物递送与释放,同时利用医学影像技术对肿瘤检测并指导治疗,是实现更安全有效的精准治疗的关键。
刺激响应的药物释放是提高药物利用率及化疗效果的有效方法之一。由于肿瘤细胞的快速增值与异常代谢,肿瘤部位具有弱酸性的微环境,因此,pH响应型药物控释被广泛采用。然而,单独的pH刺激并不能还不足以彻底地将药物快速释放到肿瘤细胞。为此,外源的刺激(例如近红外激光)被引入,以促进药物在肿瘤部位释放,实现增强的化疗效果。此外,具有良好光热性能的载体,其在近红外激光的照射下,还可产生明显的热效应,对肿瘤细胞同时具有光热杀伤效果。
本课题组的前期研究表明,碳纳米颗粒具有良好的生物相容性、较高的载药能力、优异的光热转换性能,可作为化疗药物、生物影像分子的靶向递送载体,实现多功能多模态诊疗,有利于对荷瘤小鼠肿瘤的精准定位和有效杀伤(J. Mater. Chem. B 2014, 2, 2184-2192;Carbon, 2016, 97, 35-44; Sci. Rep. 2016, 6, 23392-23402;ACS Appl. Mater. & Interfaces, 2017, 9, 9484-9495)。
在此基础上,本课题组最近利用环糊精、四氧化三铁共修饰碳纳米颗粒,构建了一种新型智能响应型诊疗一体化纳米平台(HFCNPs),用于抗癌药物的可控递送与释放,以及磁共振/近红外荧光成像介导的化疗/光热联合治疗。该纳米载体具有较高的载药能力以及优异的光热转换性能,其负载化疗药物阿霉素之后,可以通过EPR效应将药物有效地递送到肿瘤部位,并延长药物在肿瘤部位的滞留时间。同时,在肿瘤酸性微环境(内源刺激)及近红外激光(外源刺激)的双重刺激下实现了阿霉素的可控释放,有效地提高了化疗效果。我们进一步实验表明,近红外激光照射后引起的热效应可引起肿瘤部位温度上升,不仅可促进药物向肿瘤深层扩散,还可对肿瘤细胞造成光热杀伤效果,实现化疗/光热联合治疗。此外,通过磁共振/近红外荧光成像,可清晰地看到肿瘤的位置及边界,并监测治疗的效果。动物实验结果表明,单一的化疗或光热治疗对肿瘤的抑制作用有限,不能完全抑制肿瘤生长,而化疗/光热联合治疗则可有限抑制肿瘤生长,达到安全、可控及精准治疗的目的。该工作为肿瘤的早期诊断及精准治疗提供了一个新的思路。
该工作由课题组博士生宋赛杰等完成,近期被国际学术期刊ACS Applied Materials &Interfaces接受。
Saijie Song, Yu Chong, Han Fu, Xinyu Ning, He Shen, and Zhijun Zhang*. HP-beta-CD Functionalized Fe3O4/CNPs-Based Theranostic Nanoplatform for pH/NIR Responsive Drug Release and MR/NIRFL Imaging-Guided Synergetic Chemo/Photothermal Therapy of Tumor. ACS Appl. Mater. Interfaces, published online, Sept. 14, 2018, DOI: 10.1021/acsami.8b09999.
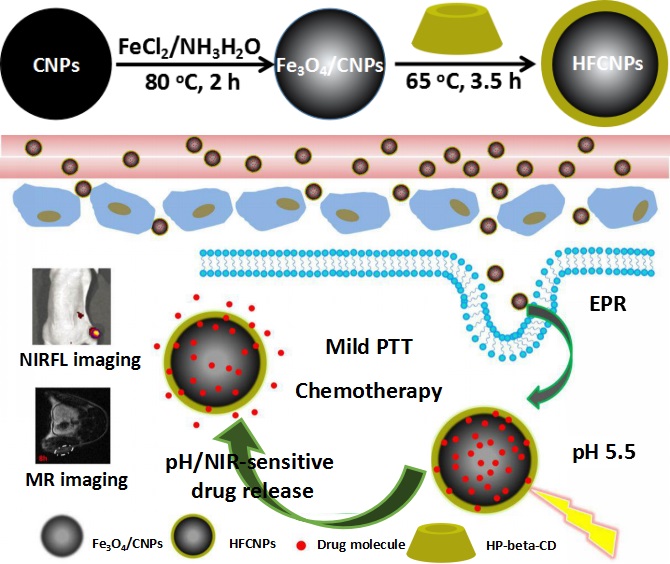
图1.HFCNPs的制备及其用于pH/NIR双重刺激响应的药物释放及MR/NIRFL双模态医学影像指导的化疗/光热联合治疗示意图。