【中国科学院 科研进展】肺纤维化治疗过程中干细胞活体示踪研究获进展
2021-08-31
肺纤维化是常见的严重慢性进行性肺间质疾病,大部分表现为特发性肺纤维化(IPF),目前缺乏有效的治疗手段。有研究表明,体内移植间充质干细胞可以有效修复该类肺损伤,而具体作用机制尚不清楚,限制了其临床应用。针对以上肺纤维化治疗临床难题,中国科学院苏州纳米技术与纳米仿生研究所张智军团队开展了肺纤维化疾病治疗过程中的移植干细胞示踪及作用机理研究。
由于肺部组织的质子密度低等特点,导致磁共振成像(MRI)等技术应用受限,临床上常采用电子计算机断层扫描(CT)技术诊断。由于CT成像灵敏度较低,常需要利用CT示踪剂对移植干细胞进行标记,实现移植干细胞的体内可视化示踪。金纳米粒子具有较高的X射线吸收性能、良好的生物相容性、易制备及表面修饰等特点,是干细胞标记和CT影像示踪的理想的纳米材料。基于上述考虑,该团队设计、制备了一系列基于金纳米粒子的干细胞示踪剂,考察了其在肺纤维化治疗过程中对移植干细胞示踪行为。研究设计合成了聚赖氨酸与牛血清白蛋白共包覆的金基纳米示踪剂。研究发现,该纳米示踪剂具有良好的生物相容性、优异的CT成像能力及超高的细胞标记效率。将该金纳米示踪剂标记的间充质干细胞注入肺纤维化小鼠肺部,实现了对肺部移植干细胞长达23天的活体示踪(Nanoscale, 2019, 11, 20932-20941)。在此基础上,为了同时考察移植干细胞的体内存活状态,研究构建了聚乙二醇(PEG)和穿膜肽(TAT)修饰的金纳米粒子示踪剂,利用其对间充质干细胞进行标记,同时结合荧光素酶报告基因,对肺纤维化小鼠体内移植干细胞进行CT和生物发光(BLI)双模态示踪(图1)。该工作利用Micro-CT影像技术高穿透深度和高空间分辨率的特点,借助BLI高灵敏度以及可识别活细胞的优势,实现了肺纤维化治疗中在体移植干细胞的高灵敏度、实时示踪,并初步探讨了干细胞参与肺纤维化治疗的再生机制(Small, 2019, 15, 1904314)。
干细胞通过分化或分泌因子对组织器官损伤进行修复是一个长期的过程,因此纳米示踪剂必须具备对其进行长时程CT影像示踪的能力。而干细胞的胞吐作用以及增殖行为往往导致胞内示踪剂的浓度逐渐降低,引起CT信号减弱直至消失,难以实现对干细胞的长时程示踪。鉴于此,研究人员设计、构建了一系列外界刺激响应智能型金纳米粒子示踪剂,克服了上述难题。研究在Au纳米粒子表面修饰一层温敏性高分子,从而获得了对温度敏感的纳米示踪剂(TRAuNPs)(图2)。在细胞标记温度39°C条件下,TRAuNPs显示出小尺寸和疏水特性,有利于细胞膜的黏附和穿透,提高了示踪剂的入胞率;而当温度恢复到正常的生理温度(37°C)时,TRAuNPs发生相变,呈现亲水性增强且体积变大,减缓了细胞的胞吐速率,延长了纳米粒子在胞内的滞留时间,达到长时程示踪的效果。进一步将该纳米示踪剂标记的干细胞移植到肺纤维化小鼠的肺部,利用高分辨率的CT成像和高灵敏度的BLI成像,实现了对移植干细胞的定位、分布和迁移过程长达10天的活体示踪。(J. Mater. Chem. B, 2021, 9, 2854-2865)。近日,该团队改进了这一策略,在金纳米粒子表面依次修饰pH响应性磺酰胺聚合物PSD和细胞穿膜肽CPP,构建了一种pH响应性金纳米粒子示踪剂CPP-PSD@Au。该纳米示踪剂在细胞摄取的过程中经历细胞内的酸性环境(内涵体和溶酶体)时,由于PSD的质子海绵效应导致对CPP的静电吸引减弱,使纳米示踪剂形成聚集体,减缓干细胞对其的外排速度,延长了示踪剂对干细胞的标记时间。在此基础上,将CPP-PSD@Au标记的间充质干细胞移植到IPF模型鼠体内,实现了对移植干细胞长达35天的动态CT示踪,并初步考察了肺纤维化治疗过程中干细胞的作用(Small, 2021, 2101861)。
为了克服单一成像模式的自身缺点,获得更互补、更丰富的移植干细胞体内信息,该团队以牛血清白蛋白(BSA)为模板,合成了金/钆纳米簇(Au/GdNC),并用二氧化硅(SiO2)壳层将其包覆,构建了Au/GdNC@SiO2纳米示踪剂,对肺纤维化小鼠体内移植干细胞进行CT/MRI双模态示踪(图3)。结果发现,SiO2壳层的包覆提高了示踪剂在标记干细胞胞内的稳定性,同时减缓了因干细胞分裂而导致的示踪剂不断稀释的效应,进一步改善了干细胞CT和MRI成像性能 (ACS Appl. Bio. Mater., 2020, 3, 2489-2498)。在此基础上,该团队与东南大学医学院教授巢杰团队合作,将CT成像技术与高灵敏度的近红外荧光(NIRF)成像技术结合,实现了移植干细胞长达21天的CT/NIRF双模态影像示踪。研究进一步揭示了在治疗肺纤维化过程中骨髓间充质干细胞通过抑制巨噬细胞活性而对受损肺组织产生抗炎和抗纤维化的作用(J. Mater. Chem. B, 2020, 8, 1713-1727)。
除了一系列金基CT示踪剂外,该团队与合作者设计、构建了聚赖氨酸修饰的近红外长余辉纳米示踪剂,而后将其与荧光素酶报告基因共同标记的干细胞移植入肺纤维化模型鼠体内,实现了对移植干细胞的位置、迁移、分布及存活状态长达30天的动态精准示踪(Biomater. Sci., 2020, 8, 3095-3105)。
该团队在干细胞纳米示踪方面的系列研究得到国际同行的关注,在View上发表了研究综述In vivo CT imaging tracking of stem cells labeled with Au nanoparticles(View, 2021, 20200119),介绍了基于金纳米粒子的干细胞示踪剂的理性设计、制备以及体内示踪应用研究进展,展望了该领域面临的挑战及未来的发展方向。
研究工作得到国家重点研发计划、国家自然科学基金及中科院的支持。
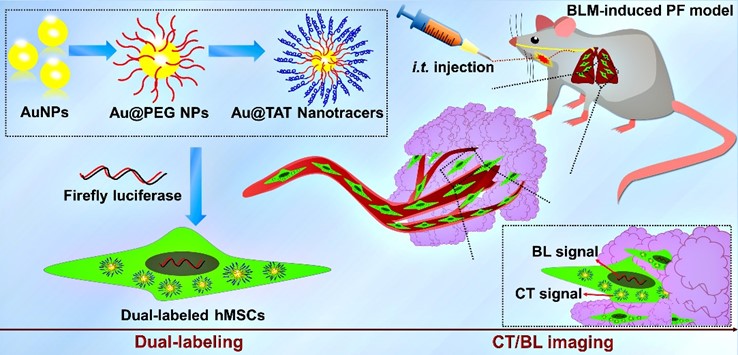
图1. 外源性Au@TAT纳米示踪剂结合内源性RfLuc报告基因双重标记hMSCs,通过CT/BLI双模态示踪移植干细胞在肺纤维化模型鼠体内的分布、迁移、存活。
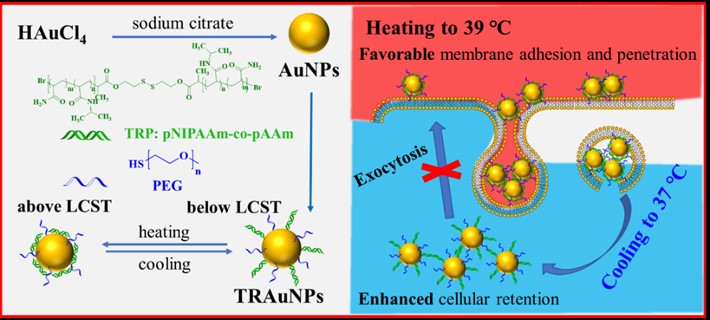
图2. 温敏性金基纳米示踪剂的制备及其对干细胞的标记与示踪示意图。
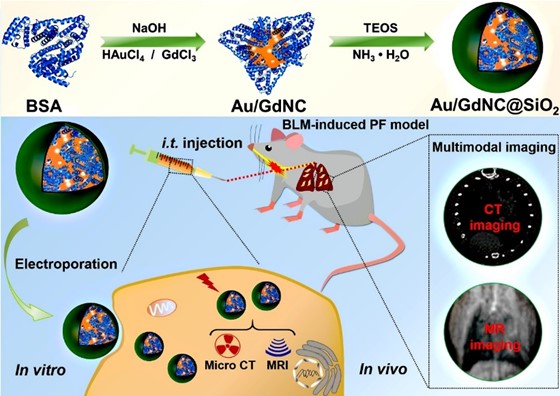
图3. Au/GdNC@SiO2纳米示踪剂用于移植间充质干细胞CT/MRI双模态活体示踪示意图。