基于金纳米颗粒的mRNA纳米探针用于追踪特发性肺纤维化治疗中移植间充质干细胞分泌的肝细胞生长因子
发布时间:2021-12-06
近年来我们课题组开展了移植干细胞在特发性肺纤维化疾病治疗过程中的示踪研究。我们前期已研制了一系列金基CT纳米示踪剂,利用CT以及其他生物影像技术实现了对移植干细胞的高灵敏度、长时程活体示踪 (Small, 2021, 17, e2101861; J. Mater. Chem. B, 2021, 9, 2854-2865; ACS Appl. Bio. Mater. 2020, 3, 2489-2498; J. Mater. Chem. B, 2020, 8, 1713-1727; Small, 2019, 15, 1904314;Nanoscale, 2019, 11, 20932-20941)。据文献报道,移植干细胞在治疗特发性肺纤维化过程中主要通过旁分泌作用来促进肺上皮细胞增殖,抑制成纤维细胞分化,减少肺间质内胶原沉积,从而抑制甚至逆转肺纤维化。因此,活体监测移植干细胞旁分泌因子,对于阐明干细胞在治疗中的作用至关重要。其中,肝细胞生长因子(HGF)是人间充质干细胞(hMSCs)的主要旁分泌可溶性因子,对肺发育过程中的气道分支和肺泡的形成起着至关重要的作用,更重要的是,其对IPF有显著的治疗作用。据此,我们设计、制备了一种新型金基纳米示踪剂(nanoflare tracer),其由金纳米颗粒(AuNP)、互补序列和染料标记的识别序列组成,基于AuNP对有机染料的淬灭作用,在没有靶向基因mRNA时,染料和AuNP紧密接近,导致荧光信号猝灭;当靶向基因mRNA存在时,识别序列脱离AuNP,导致荧光信号上升,从而实现活体追踪移植hMSCs分泌的HGF(图1)。首先通过在体外模拟nanoflare tracer的探针释放过程,发现nanoflare tracer在HGF mRNA存在的情况下具有明显的时间依赖性荧光信号响应,表明nanoflare tracer能够高效识别HGF mRNA,具有较高的灵敏度和准确性。在此基础上,我们使用nanoflare tracer直接检测肺纤维化细胞模型胞内的HGF。从图2可以看出,在实验组可以观察到显著的荧光信号,而对照组的荧光信号很微弱,表明nanoflare tracer可以特异性识别HGF,并具有较好的特异性和高效性。基于此,我们将nanoflare tracer标记的hMSCs气管插管注射到模型小鼠肺部,活体监测移植hMSCs 旁分泌HGF,并与生物发光(BL)技术结合,共同追踪移植的hMSCs。实验结果发现,nanoflare tracer的荧光信号与移植的hMSCs的BL信号有很好的重叠,说明nanoflare tracer成功捕获到HGF mRNA,并确保是在移植hMSCs中表达。在实验中我们还发现,随着移植时间的延长,双标记hMSCs的近红外荧光信号强度逐渐降低,在第4天几乎检测不到,而BL信号在第4天仍能检测到(图3)。我们分析这是因为nanoflare tracer上的探针是在不断地被消耗的,在识别HGF mRNA之后,探针会在一段时间内被机体代谢,导致荧光信号减弱。此外,AuNPs在肺部的代谢没有明显差异,这也排除了纳米粒子代谢引起信号降低的可能性。
综上,我们研发了一种新型的可识别HGF的金基纳米示踪剂,通过跟踪移植hMSCs的旁分泌过程,初步阐明了移植hMSCs在IPF治疗中的作用机制,有望推动基于干细胞的IPF治疗的临床转化。
上述成果近期在线发表在国际学术期刊Biomaterials Science上。课题组博士生鲍红英为第一作者,课题组张智军研究员,黄洁副研究员为共同通讯作者。该工作得到国家重点研发计划(2017YFA0104301)、国家自然科学基金(81801769)、中科院国际合作项目(121E32KYSB20200021)以及江苏省自然科学基金(BK20180257)等项目的资助。
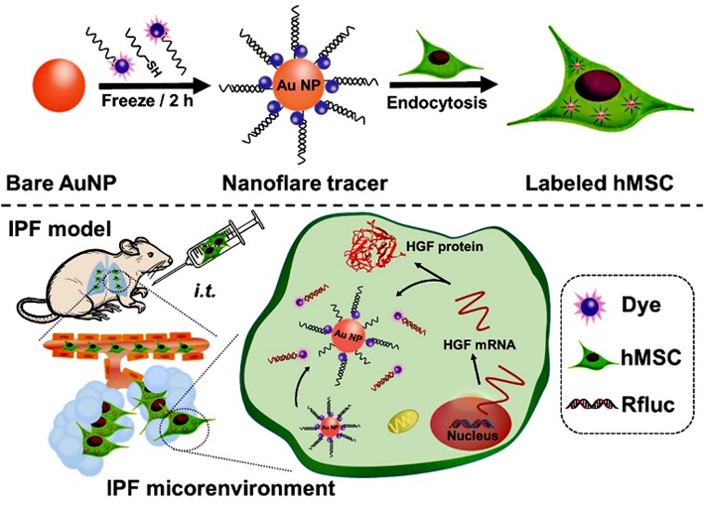
图1. Nanoflare tracer的合成原理及干细胞示踪的应用
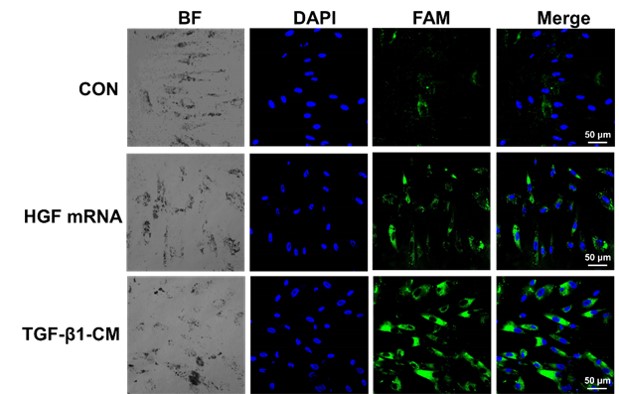
图2. Nanoflare tracer标记的hMSCs在正常培养基、外源性HGF mRNA和TGF-β1-CM不同条件下培养的荧光成像。
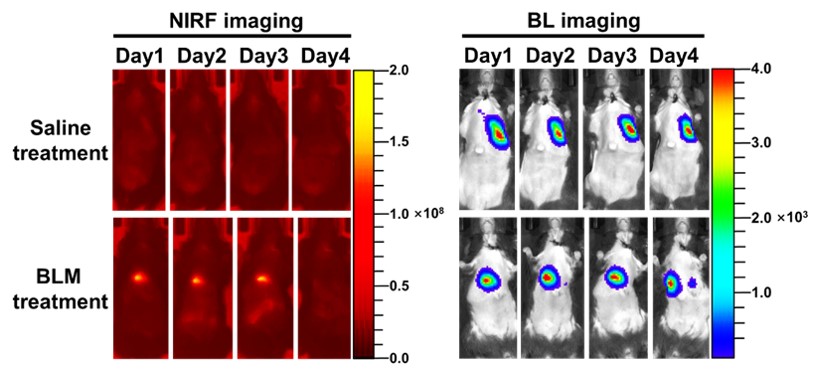
图3. 双标记hMSCs移植入IPF小鼠后1、2、3、4天的实时成像。
论文信息:
DNA-coated gold nanoparticles for tracking of hepatocyte growth factor secreted by transplanted mesenchymal stem cells in pulmonary fibrosis therapy.
Hongying Bao, Yuxuan Li, Chenggong Yu, Xiaodi Li, Yujie Wang, Li Gao, Jie Huang* and Zhijun Zhang*, Biomaterials Science, published online, 2021, DOI: 10.1039/D1BM01362A.